東北大学におけるPETを用いた医学研究は1981年に開始されました。当時の抗酸菌病研究所(現在の加齢医学研究所)教授、 松澤大樹博士(元ラジオアイソトープセンター長、現東北大学名誉教授、東北福祉大特任教授)の尽力により、1リング型 PET(米国 Ortec社製、ECAT II)を使用して始められました。これは、国立大学において最初の臨床利用の開始でありました。これに先立ち、抗酸菌病研究所放射線医学部門(現加齢医学研究所機能画像解析分野)の伊藤正敏博士(前サイクロトロン・ラジオアイソトープセンター教授)、畑澤順博士、吉岡清郎博士が英国 Hammersmith 病院に、福田寛博士が仏国 Frederic Joliot病院に留学し、その尽力によって研究の基礎が築かれました。
当時の世流は脳血流と糖代謝を中心とした脳神経学的なPETの利用でありましたが、我々は、全身のがん診断に対する代謝診断の有用性に早期から注目して、肝臓および肺のがん診断の世界的先駆けを行いました。窪田和雄博士らによるPETがん診断の研究は米国核医学会でも高く評価されました。特に、18F標識のデオキシガラクトースは、当時抗酸菌病研究所教授、多田雅夫博士らにより開発されたものであり、肝臓癌の陽性診断技術として注目を浴びました。
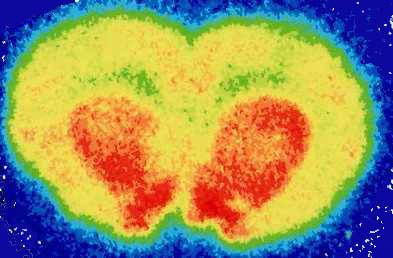
その後、1986年のPETの多段層化に伴い、脳研究が次第に中心をなすようになり、核薬学研究部による神経受容体結合薬剤の開発を受けて脳機能研究が大きく発展しました。なかでも、当時の医学部第1薬理講座(現機能薬理学分野)の谷内一彦博士の開発による中枢性ヒスタミンH1受容体認識薬の開発(図1)を元にするてんかん焦点におけるH1受容体の増加、認知症症例におけるドーパミン代謝の障害とD2受容体の過敏状態などが発見され注目を浴びました。また、その後、目黒謙一博士らによる認知症における代謝診断は新たな知見を提供してきました。
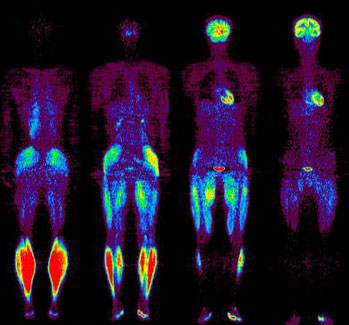
そして、1994年に全身用PET(島津製作所製 SET2400W)が導入されることにより、人体代謝の総合診断が開始されました。薬剤は糖代謝測定のスタンダードとなった18F標識のフルオロデオキシグルコース(FDG)を用いて新たな応用研究が開始されました。特に、運動に伴う全身筋肉と脳活動のマッピング(図2)は、ユニークな試みとして高く評価され、研究推進者である藤本敏彦博士や田代学(サイクロトロン核医学研究部教授)らは多くの会議において高い評価を得ました。このような、正常者における生理的研究への核医学利用には、全身3次元PETの利用が不可欠です。これには、石井慶造博士のスーパーコンピューターとPETのドッキングの試みが効果的であり、63断面の画像再構成時間は、わずか1分で終了しました(当時、世界最高速)。また、放射線被曝は、2次元PETの1/10まで低減させることが可能となりました。
こうした技術的進歩に支えられて、脳の生理学的研究は、更に進歩し、川島隆太博士を中心とする認知機能研究、長沢治夫博士を中心とするバイリンガル脳処理に関する研究、樋口真人博士をリーダーとする receptor activation の研究が行われました。
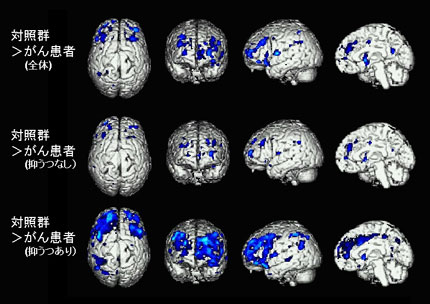
東北大学では、がん診断にPETを応用する研究が先駆的に開始されましたが、その成果は世界中に拡がりました。欧米の各国では、日本国内に先駆けて保険診療としてのPET検査が開始されました。日本国内においても、そうした世界の流れを受けつつ、日本核医学会の努力の結果、ようやく主にがん検査として2004年より健康保険が適用され、一般の病院でも検査を受けることができるようになりました。これを機に、PETを導入した病院はどんどん増加しており、2007年時点で200カ所近い施設が運営されています。このことは、ある意味、「PETがん診断」という先駆的研究テーマに着手し、初期の研究データを世界に発信しつづけた東北大学の誇るべき成果でもあります。FDGは、がん検査以外にも,脳や心臓、全身の筋肉のエネルギー消費量を測定する目的にも使用され、高感度カメラの開発とともに、生理学的な研究にも利用されるようになっていきました。加えて、21世紀の到来とともに、医療の現場において、クオリティ・オブ・ライフ(QOL)の重要性、「心の医療」の大切さが認識されるようになり、がん患者の心理的変化をPET脳画像で評価する可能性を追求する新しい臨床研究も行われました(図3)。
ところで、私たちの脳を形づくる神経細胞は「伝達物質」を放出して他の神経細胞にメッセージを伝えています。放出された神経伝達物質のメッセージは,隣の神経細胞の表面の「受容体」が受け取り、その細胞の活動を調節しています。このような調節機構のおかげで私たちの「精神-こころ」が一定の状態に保たれています。神経伝達物質にはいろいろな種類があり,ドーパミン,セロトニン,アセチルコリン,ヒスタミンなどがありますが,それぞれ脳内での役割が異なっています。PETをうまく使うことで,体内のごく微量な伝達物質や受容体など「生体内分子」が活動する様子を体外から,しかも生きたままの状態で観察することができます。病気による目にみえない変化を診断したり,内服した薬が体内でどのように作用するかを調べることもできます。こうした研究領域は最近,「分子イメージング」とよばれ,世界中で活発に研究が行われています。
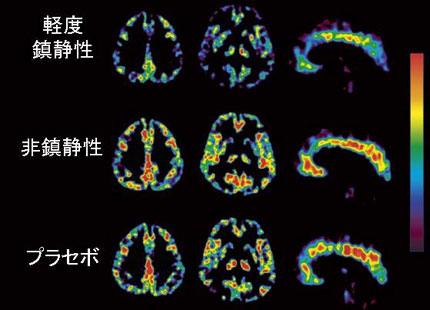
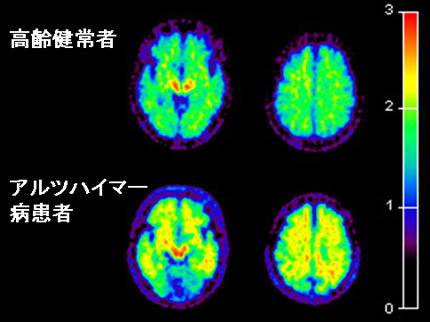
当センターにおいても,運動と脳内ドーパミンの関係や,抗ヒスタミン薬(花粉症の治療薬)の眠気を科学的に評価する研究(図4),認知症の新しい診断薬の研究(図5)、アセチルコリン神経に作用する薬剤(ドネペジル)の研究(図6),低酸素状態の細胞を発見するための診断薬の開発など様々な研究が活発に進められています。こうした研究分野における東北大学の最近の研究でとくに注目すべきは、認知症(特にアルツハイマー病)の患者さんの脳内に蓄積するベータ・アミロイドとよばれる異常なタンパク質の蓄積状態を画像化するための薬剤開発・臨床評価を全く独自に行ったことです(図5)。この分野はアミロイド・イメージングとして、世界中で活発に競争が行われていますが、 国内では初の試みとして注目を集めております。こうした医学的応用研究は,医学系研究科や先進医工学機構などとの学内共同利用事業や放射線医学総合研究所との連携事業などに基づいた共同研究として推進されています。放射線医学総合研究所とは、連携協定により、「分子イメージング」人材育成を目指した連携大学院講座が設立されました。
分子イメージング研究を支える技術開発にもめざましいものがあります。平成19年度に石井慶造博士を中心とするグループが世界で初めて1ミリメートル以下という超高分解能の半導体PETの開発に成功しました。また、核薬学研究部の岩田錬教授のグループが標識合成システムのミニチュア化に成功いたしました。今後、ますますの発展が期待される状況です。